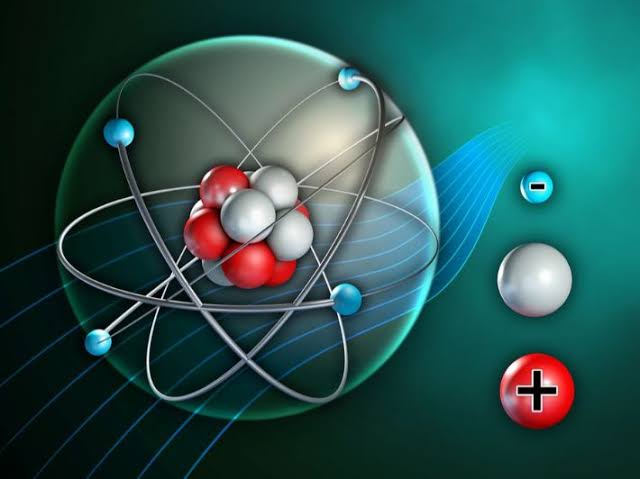
1. الكتلة والشحنة:
الإلكترونات تحمل كتلة صغيرة نسبيًا بالمقارنة مع البروتونات والنيوترونات الموجودة في النواة الذرية. الكتلة الإلكترونية تُعادل حوالي 1/1836 من كتلة البروتون. بالإضافة إلى ذلك، تحمل الإلكترونات شحنة سالبة تُعبر عنها بـ”e-“، وهي تكافئ -1 واحد.
2. التوزيع الإلكتروني:
الإلكترونات توجد حول النواة الذرية في مدارات معينة. يتم تنظيم الإلكترونات في مستويات طاقة مختلفة تُعرف باسم المدارات أو الأغمات. توجد الإلكترونات في المستويات الأدنى للطاقة في المدارات الداخلية، بينما توجد في المستويات العليا للطاقة في المدارات الخارجية.
3. الترتيب الإلكتروني:
يتم ترتيب الإلكترونات في المدارات وفقًا لقواعد معينة. يُعرف نظام العدد الكمي والقواعد الكهربائية بترتيب الإلكترونات في المدارات ومعرفة عدد الإلكترونات في كل مستوى طاقة ومدار.
4. الدوران والدورة:
الإلكترونات تتحرك حول النواة الذرية بسرعات عالية وتتأثر بقوى الجاذبية والكهرومغناطيسية. هذا الحركة الدورانية تمنح الإلكترونات الطاقة، وهناك مستويات معينة للطاقة تعبر عنها بأزمة الطاقة وتعتمد على العدد الكمي والمدار.
5. السلوك الكيميائي:
تلعب الإلكترونات دورًا حاسمًا في السلوك الكيميائي للعناصر. عندما تشارك العناصر في تفاعلات كيميائية، يتم تبادل الإلكترونات بينها. تحدد توزيع الإلكترونات وعددها كيفية تكوين الروابط الكيميائية والتفاعلات بين العناصر.
6. الخصائص الكهرومغناطيسية:
تؤثر الإلكترونات على الخصائص الكهرومغناطيسية للمواد. عندما تحمل الإلكترونات تغيرات في حالتها الطاقوية، يمكن أن تنتج أشعة كهرومغناطيسية مثل الضوء والأشعة تحت الحمراء والأشعة فوق البنفسجية والأشعة السينية.
7. الأهمية الصناعية والتكنولوجية:
الإلكترونات لها أهمية كبيرة في التكنولوجيا الحديثة، حيث تمثل الأساس لعمليات تكنولوجية مثل الإلكترونيات والكهروضوئية والإلكترونيات الحيوية والحواسيب والاتصالات. إن فهم خصائص الإلكترونات يساهم في تطوير تلك التقنيات وتقدم العلوم والتك